SURVEY: PERCHÉ NON HO SCELTO LA DIALISI PERITONEALE?
Un’analisi delle barriere alla scelta terapeutica nei pazienti in emodialisi
Cinzia Aldrigo¹, Erminia Garritano¹, Michela Ippolito².
¹ U.O. di Dialisi, ASST Santi Paolo e Carlo, Milano, Italia;
² Coordinatrice Infermieristica, U.O. di Dialisi, ASST Santi Paolo e Carlo, Milano, Italia.
INTRODUZIONE:
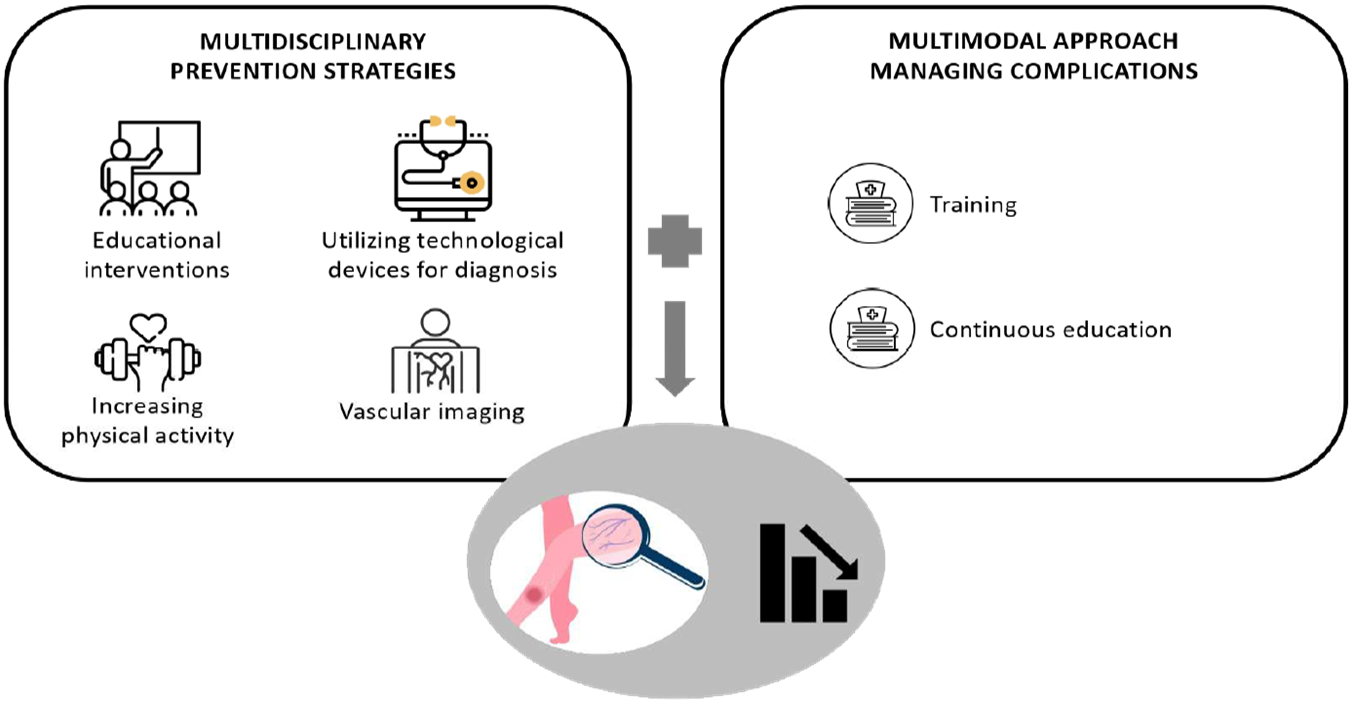
La dialisi peritoneale (DP) rappresenta un’opzione terapeutica valida e spesso vantaggiosa per molti pazienti con insufficienza renale terminale, ma, nonostante ciò, un numero significativo di pazienti non viene trattato con questa modalità. Questa survey si propone di esplorare le motivazioni, le percezioni e le barriere che impediscono l’adozione della dialisi peritoneale, analizzando il ruolo della comunicazione.
Una survey condotta su un campione di pazienti affetti da insufficienza renale cronica in emodialisi, emergono fattori decisionali cruciali, come la mancanza di informazioni adeguate, la percezione della dialisi peritoneale come modalità meno sicura rispetto alla dialisi emodialitica, le difficoltà pratiche legate alla gestione domiciliare e la preferenza per un trattamento più “passivo” come l’emodialisi.
METODOLOGIA:
La dialisi peritoneale (DP) rappresenta un’opzione terapeutica valida e spesso vantaggiosa per molti pazienti con insufficienza renale terminale, ma, nonostante ciò, un numero significativo di pazienti non viene trattato con questa modalità. Questa survey si propone di esplorare le motivazioni, le percezioni e le barriere che impediscono l’adozione della dialisi peritoneale, analizzando il ruolo della comunicazione.
Una survey condotta su un campione di pazienti affetti da insufficienza renale cronica in emodialisi, emergono fattori decisionali cruciali, come la mancanza di informazioni adeguate, la percezione della dialisi peritoneale come modalità meno sicura rispetto alla dialisi emodialitica, le difficoltà pratiche legate alla gestione domiciliare e la preferenza per un trattamento più “passivo” come l’emodialisi.
RISULTATI:
Ecco una tabella riassuntiva che mostra la distribuzione per età e sesso, con le percentuali relative all’interno di ciascun gruppo:
Tabella Riassuntiva distribuzione per età e sesso, con percentuali di ciascun gruppo:
| Fascia di Età | Maschi | Femmine | Totale | Percentuale Maschi (%) | Percentuale Femmine (%) |
| 18-30 anni | 1 | 3 | 4 | 25% | 75% |
| 31-50 anni | 5 | 4 | 9 | 55,56% | 44,44% |
| 51-70 anni | 14 | 6 | 20 | 70% | 30% |
| 71+ anni | 15 | 7 | 22 | 68,18% | 31,82% |
| Totale | 35 | 20 | 55 | 63,64% | 36.36% |
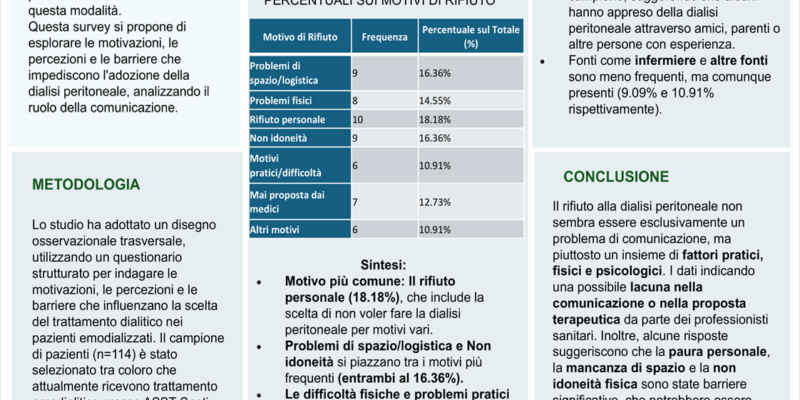
Tabella Riassuntiva con Percentuali sui motivi di rifiuto:
| Motivo di Rifiuto | Frequenza | Percentuale sul Totale (%) |
| Problemi di spazio/logistica | 9 | 16,36% |
| Problemi fisici | 8 | 14,55% |
| Rifiuto personale | 10 | 18,18% |
| Non idoneità | 9 | 16,36% |
| Motivi pratici/difficoltà | 6 | 10,91% |
| Mai proposta dai medici | 7 | 12,73% |
| Altri motivi | 6 | 10,91% |
Sintesi:
- Motivo più comune: Il rifiuto personale (18.18%), che include la scelta di non voler fare la dialisi peritoneale per motivi vari.
- Problemi di spazio/logistica e Non idoneità si piazzano tra i motivi più frequenti (entrambi al 16.36%).
- Le difficoltà fisiche e problemi pratici nella gestione sono anch’essi motivi rilevanti, ma meno frequenti.
Tabella Riassuntiva con Percentuali da chi ha ricevuto informazioni:
| Fonte di Informazione | Frequenza | Percentuale sul Totale (%) |
| Medico | 19 | 34,55% |
| Infermiere | 5 | 9,09% |
| Conoscenze personali | 8 | 14,55% |
| Altro (fonti diverse) | 6 | 10,91% |
| Mai ricevute informazioni | 17 | 30,91% |
Sintesi:
- Fonte principale di informazioni: Il medico è la fonte principale di informazioni sulla dialisi peritoneale, con il 34.55% del campione che ha ricevuto informazioni da un medico.
- Un numero significativo di persone (30.91%) non ha ricevuto alcuna informazione sulla dialisi peritoneale.
- Conoscenze personali rappresentano il 14.55% del campione, suggerendo che alcuni hanno appreso della dialisi peritoneale attraverso amici, parenti o altre persone con esperienza.
- Fonti come infermiere e altre fonti sono meno frequenti, ma comunque presenti (9.09% e 10.91% rispettivamente).
CONCLUSIONI:
Dall’analisi delle risposte emerse dalla domanda “Perché non ha scelto la dialisi peritoneale?”, possiamo osservare che i motivi del rifiuto alla dialisi peritoneale sono principalmente legati a fattori fisici, pratici e personali. Le motivazioni più comuni includono difficoltà logistiche, come la mancanza di spazio adatto in casa o l’ambiente non idoneo per la dialisi (16.36%), seguite dalla paura o rifiuto personale (18.18%) e dalle difficoltà fisiche, come la non idoneità fisica o precedenti interventi chirurgici (14.55%). Un numero consistente di pazienti ha anche riferito che non gli è stata mai proposta la dialisi peritoneale (12.73%) o che sono stati considerati non idonei dai medici (16.36%).
Analizzando le fonti di informazione sulla dialisi peritoneale, emerge che la maggior parte dei pazienti ha ricevuto queste informazioni dal medico curante (34.55%), mentre una percentuale significativa ha dichiarato di non aver ricevuto alcuna informazione (30.91%). Le conoscenze personali e le fonti alternative (come infermieri e altre persone) sono state meno frequenti, suggerendo che il percorso informativo potrebbe non essere stato uniforme tra i pazienti.
Il Rifiuto come Possibile Problema di Comunicazione?
Il rifiuto alla dialisi peritoneale non sembra essere esclusivamente un problema di comunicazione, ma piuttosto un insieme di fattori pratici, fisici e psicologici. Sebbene la maggior parte dei pazienti abbia ricevuto informazioni dai medici, un numero significativo di pazienti non ha mai ricevuto una proposta concreta di dialisi peritoneale, indicando una possibile lacuna nella comunicazione o nella proposta terapeutica da parte dei professionisti sanitari. Inoltre, alcune risposte suggeriscono che la paura personale, la mancanza di spazio e la non idoneità fisica sono state barriere significative, che potrebbero essere state meglio gestite con una comunicazione più chiara e una consulenza mirata sulle opzioni terapeutiche disponibili.
In conclusione, sebbene la comunicazione svolga un ruolo importante nella decisione del paziente, il rifiuto alla dialisi peritoneale appare essere principalmente legato a fattori pratici e individuali piuttosto che a una carenza informativa. Tuttavia, migliorare la comunicazione e la discussione delle alternative terapeutiche potrebbe favorire scelte più consapevoli e personalizzate, soprattutto per coloro che non hanno ricevuto informazioni adeguate o che non sono stati correttamente valutati per la dialisi peritoneale.
POSTER
BIBLIOGRAFIA
- Cancarini, G., Santarelli, S., Vizzardi, V., Amici, G., Alberghini, E., Russo, R., Neri, L., Dattolo, P., Maggiore, U., Mandreoli, M., Mariano, F., & Bianchi, S. Governo clinico in nefrologia: organizzazione e sviluppo della dialisi peritoneale. G Ital Nefrol 2024 – ISSN 1724-5990 – © 2024 Società Italiana di Nefrologia – Anno 41 Volume 5
- Murray, P. T., & Popp, J. (2017). Peritoneal Dialysis: Evolution, Applications, and Future Perspectives. American Journal of Kidney Diseases, 69(4), 507-515.
- Stucchi, L., & Cozzi, G. (2014). È possibile ridurre i pazienti in emodialisi? Le alternative. Congresso della Sezione Lombarda della Società Italiana di Nefrologia.
- Twardowski, Z. J., & Daugirdas, J. T. (2022). Peritoneal Dialysis in Practice: Techniques and Methods. Springer.