L’INFLUENZA DELL’INTELLIGENZA ARTIFICIALE NELLA PREVISIONE DELL’IPOTENSIONE INTRADIALITICA (IDH): una revisione della letteratura
Giada Vrenna, Alessandro Mento, Carla Vives Benedi.
ASST GOM Niguarda, Milano
INTRODUZIONE:
La malattia renale cronica (CKD) è una condizione progressiva caratterizzata da cambiamenti strutturali e funzionali del rene dovuti a varie cause che frequentemente porta allo stadio terminale (ESRD), richiedendo un trattamento di dialisi o un trapianto di rene. Secondo le linee guida KDOQI del 2005 e le successive modifiche KDIGO del 2012 è in genere definita come una riduzione della funzionalità renale, una velocità di filtrazione glomerulare stimata (eGFR) inferiore a 60 mL/min per 1,73 m² o la presenza di marcatori di danno renale o anomalie rilevate tramite esami di laboratorio o imaging che sono presenti da almeno 3 mesi. (Levey AS et al., 2005 – Stevens PE et al., 2013)
Il peso globale della malattia renale cronica è sostanziale ed in crescita: circa il 10% degli adulti in tutto il mondo è affetto da qualche forma di malattia renale cronica, traducendosi in 1,2 milioni di decessi. (Kalantar-Zadeh K et al. ,2021)
Nonostante i recenti progressi nel campo della dialisi, l’elevata mortalità dei soggetti con malattia renale allo stadio terminale (ESRD) sottoposti a terapia sostitutiva rimane una delle principali sfide. (Saran R. et al., 2019)
L’ipotensione intradialitica (IDH) rappresenta una delle complicanze più comuni dell’ emodialisi (HD) nella pratica clinica. E’ caratterizzata da un calo significativo della pressione sanguigna durante le sedute emodialitiche e la sua prevalenza varia dall’ 8 a 40%.(Yu J et al. ,2018- Kuipers J et al. ,2019). Le ragioni di questa discrepanza potrebbero essere dovute all’uso di definizioni differenti di IDH e/o a diverse caratteristiche del paziente quali: età, presenza di diabete, malattie cardiovascolari, aumento eccessivo di peso interdialitico (IDWG), distribuzione del peso e del genere.
Nel 2005 le linee guida della National Kidney Foundation Kidney Disease Outcomes Quality Initiative (KDOQI) hanno definito l’IDH come una diminuzione della pressione arteriosa sistolica di >= 20 mm/ Hg o della pressione arteriosa media di 10 mm /Hg in combinazione con sintomi di ipotensione quali crampi, vomito o dolore al petto.(K/DOQI Workgroup, 2005). Hanno fatto seguito le Best Practice Europee, che hanno definito l’IDH come una diminuzione della pressione arteriosa sistolica >20 mm Hg in combinazione con interventi clinici e infermieristici associati.(Kooman J et al., 2007). Altri gruppi di Linee guida nazionali e cliniche hanno sostanzialmente adottato definizioni simili basate sulle indicazioni della KDOQI del 2005 o dall’European Best Practices Group (EBPG) del 2007 con alcune varianti tra cui: qualsiasi episodio di diminuzione della PA durante la dialisi che richiede un intervento immediato, un calo improvviso e sintomatico della pressione arteriosa sistolica (PAS) di 30 mmHg o una diminuzione in MAP di 10 mmHg oppure la Definizione Nadir 90 cioè, la riduzione della pressione arteriosa sistolica al di sotto di 90 mmHg, che meglio correla con la mortalità. (Flythe JE et al., 2015 – Ashby D et al. ,2019).
L’eziologia dell’ IDH è multifattoriale e coinvolge vari fattori di rischio come l’eccessiva ultrafiltrazione (UF), una valutazione errata del peso target, uno stato nutrizionale compromesso, la presenza di anemia, di cardiopatia ischemica, la compromissione dei riflessi cardiovascolari, la disfunzione autonomica e la disregolazione endoteliale. (Sulowicz W et al. ,2006).
Le soluzioni tradizionali per la gestione dell’ipotensione durante la dialisi includono azioni tipo il posizionamento del paziente nella posizione di Trendelenburg per favorire il ritorno venoso, ridurre o interrompere l’ultrafiltrazione, somministrare soluzione salina per ripristinare il volume intravascolare, l’uso di temperature del dializzato più basse, la regolazione della concentrazione di sodio nel dializzato. (Kanbay M et al., 2020- Chou JA et al.,2017 – Hamrahian SM et al., 2023) Inoltre, sono importanti strategie preventive durante il periodo interdialitico, la gestione dell’aumento di peso (IDW) e la regolazione dei farmaci antipertensivi. (Cedeño S. et al.,2020).
Ad ogni modo, il verificarsi di questa complicanza continua a rappresentare un problema sanitario importante al giorno d’oggi. Il profilo dei pazienti negli ultimi decenni è cambiato, aumentando l’incidenza e la prevalenza di fragilità e comorbilità multiple esponendolo maggiormente al rischio di soffrire di IDH e delle sue conseguenze anche gravi tra cui lo stordimento miocardico, danni miocardici silenti, ischemia cerebrale, ischemia intestinale, causando un aumento del rischio di ospedalizzazione, comparsa di eventi cardiovascolari, alterazione della qualità della vita e nei casi più gravi mortalità. (Chou JA et al., 2018- Stefánsson BV et al., 2014 – Burton JO et al. ,2009 – McIntyre CW et al. ,2015 – Daugirdas JT ,2001).
Inoltre, il realizzarsi di questa condizione implica l’interruzione della seduta somministrando una minore dose di dialisi, genera un sovraccarico di volume rendendo difficile il raggiungimento del peso secco per la frequente infusione di fluidoterapia, influisce sulla funzione renale residua nei nuovi pazienti sottoposti a dialisi, è causa di trombosi dell’accesso vascolare di tipo fistola arterovenosa, facilita il passaggio delle endotossine dal lume intestinale al circolo sanguigno attraverso l’ischemia intestinale. (Hajal J et al., 2019).
Tuttavia, misure preventive come gli aggiustamenti del peso secco, la profilazione del sodio e il raffreddamento del dialisato hanno dimostrato risultati limitati di efficacia nel ridurre l’incidenza di IDH. Pertanto, vi è un’urgente necessità di dati più accurati e approcci personalizzati per prevedere e prevenire questa complicanza. L’incorporazione dell’intelligenza artificiale (IA) potrebbe fornire un metodo completamente nuovo all’analisi dei dati consentendo progressi innovativi nelle terapie dialitiche.
Negli ultimi anni, l’applicazione dell’intelligenza artificiale (IA) e dell’apprendimento automatico (ML) hanno guadagnato notevole attenzione in vari campi medici tra cui la gestione della malattia renale cronica e dell’emodialisi. (Gaweda AE et al. ,2020).
L’incorporazione dell’ IA potrebbe fornire un metodo completamente nuovo all’analisi dei dati aprendo le porte a interventi preventivi consentendo progressi innovativi nelle terapie dialitiche.
OBIETTIVO
Nella previsione dell’IDH i modelli di apprendimento automatico hanno mostrato risultati promettenti utilizzando vari predittori e metriche di performance. Ad ogni modo, è necessario consolidare le conoscenze disponibili dalla letteratura per ottenere una comprensione completa dell’uso dell’IA e la sua applicazione. Questa revisione riassume e analizza articoli pertinenti sull’applicazione di modelli di apprendimento automatico per la previsione dell’IDH. Esaminando questi articoli è possibile identificare tendenze comuni, valutare le prestazioni di diversi modelli di ML e fornire raccomandazioni per la ricerca futura.
MATERIALI E METODI
È stata condotta una revisione narrativa della letteratura (Grant e Booth, 2009) seguendo la metodologia riportata nella “Scale for the Assessment of Narrative Review Articles” (SANRA), che prevede sei fasi: (1) Giustificare l’importanza della revisione; (2) Dichiarare gli scopi specifici o formulare quesiti di ricerca; (3) Descrivere la strategia di ricerca adottata; (4) Attribuire le referenze alle dichiarazioni sintetizzate; (5) Dimostrare un ragionamento scientifico nella discussione; (6) Riportare i dati in modo appropriato. (Baethge et al., 2019)
La domanda di ricerca è stata formulata utilizzando il modello PICO attraverso l’analisi di tre elementi PIO: (P) Pazienti sottoposti ad emodialisi (HD); (I) Identificare gli studi che applicano l’intelligenza artificiale nella previsione dell’IDH; (O) Valutare l’impatto di predittori e metriche di performance di intelligenza artificiale adeguate ai risultati nella previsione dell’IDH.
La ricerca ha comportato l’identificazione di report pertinenti pubblicati in letteratura tramite interrogazione di banche dati scientifiche (PubMed/Medline, Embase, EBSCO,Web of Science, Cochrane Library) siti Web di Società Scientifiche ed archivi digitali; la strategia di ricerca implementata è stata finalizzata alla selezione dei record con le parole chiave «Artificial Intelligence AND Intradialytic hypotension», inclusi termini MeSH e operatori booleani presenti nel titolo e nel testo. I riferimenti e le citazioni dagli articoli selezionati sono stati esaminati per identificare ulteriori studi oggetto di revisione. La popolazione target includeva studi che hanno esaminato l’applicazione di modelli dell’ IA per la previsione dell’IDH nei pazienti adulti sottoposti ad emodialisi di mantenimento (HD). Una prima selezione è avvenuta per pertinenza dopo lettura di titolo e abstract; successivamente al reperimento in full text dei documenti eleggibili si è proceduto ad un ulteriore processo di screening per rilevanza dopo lettura integrale. Quelli da includere nella revisione sono stati sottoposti ad analisi e sintesi narrativa. Ammissibili per l’inclusione sono stati tutti gli studi incentrati sull’applicazione di modelli di apprendimento automatico per prevedere l’IDH nei pazienti adulti sottoposti ad emodialisi: (a) in lingua inglese, italiana, spagnola; (b) con testo integrale disponibile; (c) condotti con qualunque metodologia di ricerca. Non sono stati imposti limiti temporali rispetto alla data di pubblicazione. Sono stati esclusi gli articoli che non soddisfacevano i criteri di inclusione: (1) se si concentravano esclusivamente su analisi descrittive o esplorative senza modelli di previsione; (2) valutavano metodi ML generali senza applicazione specifica a IDH; (3) erano case report, revisioni, editoriali o erano inaccessibili per l’estrazione dei dati.
RISULTATI
PROCESSO DI SELEZIONE
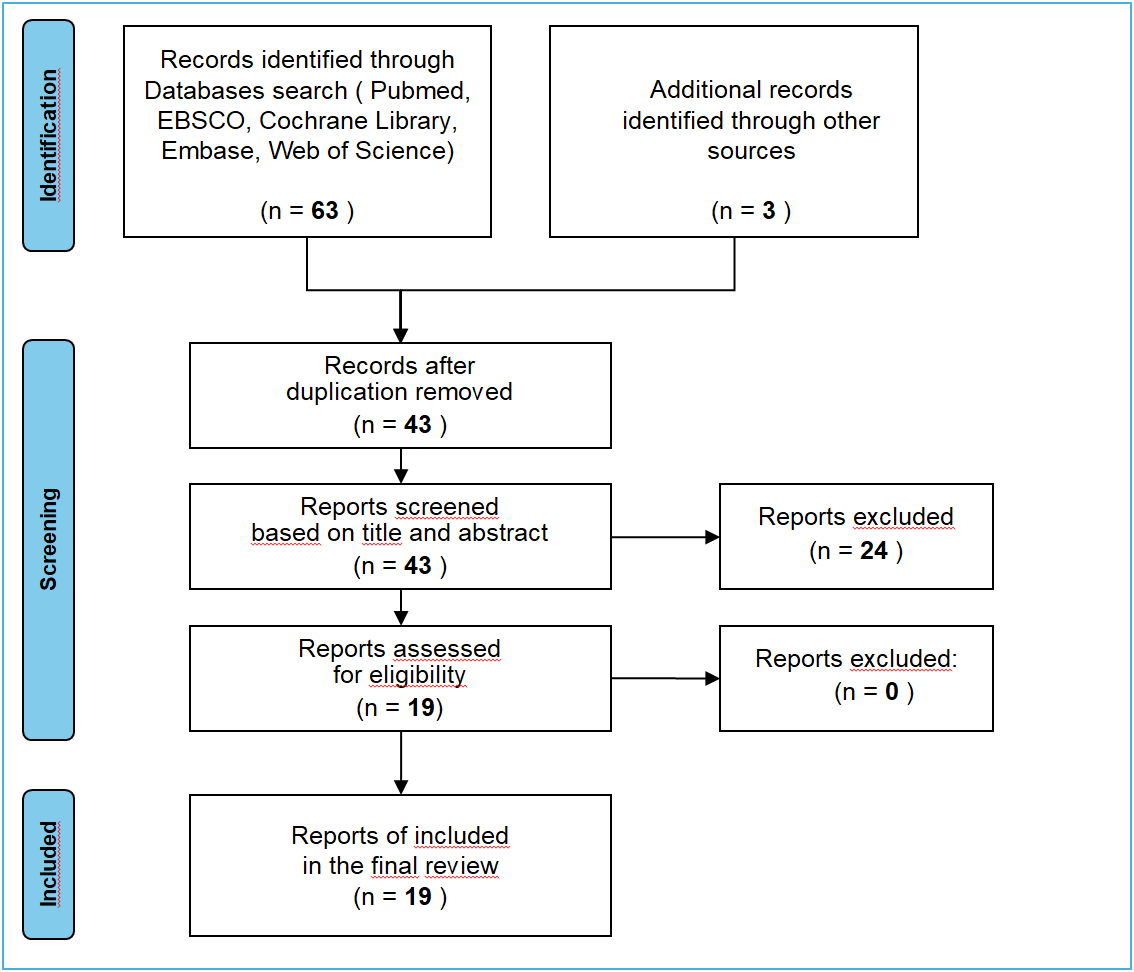
L’interrogazione dei database biomedici è avvenuta tra Dicembre 2024 e Gennaio 2025. I record individuati sono stati complessivamente 66. Dopo rimozione dei duplicati n.23 ed al termine del processo di selezione per titolo e abstract sono stati ritenuti eleggibili 19 record a cui sono corrisposti altrettanti documenti eleggibili in full text; di essi, dopo lettura integrale e screening per rilevanza, il processo di selezione, consistente nella flowchart PRISMA, ha permesso di includere nella presente revisione 19 articoli.
Flowchart PRISMA
CARATTERISTICHE DEGLI STUDI
La prevenzione dell’IDH è emersa come tema principale in tutti gli studi evidenziando, come l’integrazione di strumenti di apprendimento automatico (Machine Learning ML) e intelligenza artificiale (AI) possano supportare gli operatori sanitari nella gestione clinica dei pazienti con malattia renale cronica (MRC) sottoposti a emodialisi (HD). Gli studi inclusi hanno utilizzato vari modelli AI e ML per prevedere l’IDH nei pazienti in emodialisi. Hanno coinvolto analisi retrospettive di grandi set di dati e registri di dialisi avvalendosi di diversi algoritmi, come reti neurali artificiali (ANN), alberi decisionali (DT), macchine a vettori di supporto (SVM), XGBoost, foreste casuali (RF), LightGBM, metodi di ensamble. Sono stati utilizzati anche apparecchiature elettromedicali come l’ECG e il PPG. I set dati utilizzati per lo sviluppo dei modelli variavano ma comunemente includevano dati demografici dei pazienti (età, sesso, peso corporeo), dati clinici (malattia primaria, comorbilità, complicazioni), risultati di laboratorio (emoglobina, albumina, elettroliti) e parametri correlati alla dialisi (portata del flusso sanguigno, dose dialitica, pressione arteriosa, pressione venosa, pressione arteriosa sistolica, pressione arteriosa diastolica, velocità di ultrafiltrazione, incremento ponderale, peso secco).
Gli studi presenti nella revisione sono stati condotti in vari paesi del mondo: Europa (Spagna/Portogallo n = 4); Stati Uniti n = 2 ; Asia (Cina n = 3), (Taiwan n= 4) (Corea n = 4) (Iran n = 1); Africa(Egitto n =1); tra il 2018 e il 2024.
La revisione dei risultati ha portato alla suddivisione in tre macro-aree: (a) Predire l’IDH mediante l’utilizzo di strumenti elettromedicali; (b) Previsione del rischio di IDH in base al tempo di comparsa come supporto al processo decisionale da parte del personale sanitario; (c) Predire IDH attraverso set di dati specifici estrapolati prima e/o durante il trattamento dialitico e dalle condizioni cliniche dei pazienti.
- PREDIRE IDH MEDIANTE L’UTILIZZO DI STRUMENTI ELETTROMEDICALI
Vaid et al. (2023), hanno creato un framework di apprendimento profondo basato sui dati ricavati dagli elettrocardiogrammi (ECG) effettuati entro 48 ore prima del trattamento, con un valore soglia che produceva una sensibilità di 0,8, ed una una specificità di 0,59. (Nafisi et al. 2018), invece, hanno utilizzato diverse caratteristiche del segnale della fotopletismografia digitale (PPG) per l’identificazione di tre episodi di classe (non-IDH, pre- IDH e IDH) tramite algoritmo genetico (GA) insieme ad AdaBoost. Il metodo proposto è risultato efficace nell’ identificare e classificare con una precisione media di 94,5 ± 1,0.
- PREVISIONE DEL RISCHIO DI IDH IN BASE AL TEMPO DI COMPARSA COME SUPPORTO AL PROCESSO DECISIONALE DA PARTE DEL PERSONALE SANITARIO
Nello studio di (Dong et al. 2023) sono stati convalidati due tipi di modelli ML predittori di IDH, il modello IDH-A è stato sviluppato per la previsione del rischio per il successivo trattamento emodialitico con statistiche di C 0,82, il secondo modello IDH-B è stato sviluppato per la valutazione del rischio prima di ogni trattamento di emodialisi con statistiche C di 0,68. Il metodo LightGBM è risultato facilmente interpretabile e dalle buone prestazioni. (Zhang H. et al. 2023) hanno sviluppato un modello con algoritomo XGBoost per la previsione in tempo reale di IDH . Il loro modello ha raggiunto un’area sotto la curva caratteristica operativa del ricevitore (AUROC) di 0,89 per la previsione dell’ipotensione con 15-75 minuti di anticipo. Mendoza-Pitti et al. (2022), invece hanno definito l’IDH come una diminuzione della pressione sanguigna sistolica (PAS) di 20 mmHg o più se una qualsiasi delle PAS misurate all’ora 1, all’ora 2, all’ora 3 e all’ora 4 era inferiore alla PAS misurata “ all’ora 0’’. I risultati hanno mostrato che il loro modello basato su XGBoost, ha le migliori prestazioni, mostrandosi affidabile termini di identificazione di IDH o non-IDH con un’area sotto la curva (AUC) per la caratteristica operativa del ricevitore (ROC) di 0,969 e un’AUC per il richiamo di precisione (PR) di 0,945. (Hyung W. K. et al. 2022) hanno sviluppato un modello di apprendimento profondo basato su una rete neutrale convoluzionale (CNN), ottenendo le migliori prestazioni nel predire IDH nelle varie definizioni presenti in letteratura prevedendo gli episodi di IDH con 10 minuti di anticipo utilizzando solo i dati generati durante l’emodialisi, senza violazione della privacy. (Lee H. et al. 2021) hanno utilizzato un modello di deep learning per predire il rischio di IDH entro 1 ora distinguendo 3 definizioni di IDH (1-2-3). Il modello di rete neurale ricorrente per la previsione di IDH 1 ha raggiunto un’area sotto la curva caratteristica operativa del ricevitore di 0,94, per la previsione di IDH 2 e di IDH 3 ha raggiunto un’area sotto la curva caratteristica operativa del ricevitore di 0,87. Allo steso modo (Yang IN et al. 2024) hanno implementato una dashboard digitale visualizzando la probabilità in tempo reale di IDH per ciascun paziente, entro 60 minuti. Il modello di previsione XGBoost ha mostrato un’ AUC più elevato (accuratezza: 0,858, sensibilità: 0,858, specificità: 0,858, area sotto la curva: 0,936). La dashboard digitale potrebbe aiutare a fornire un intervento adeguato per prevenire l’IDH consentendo al personale sanitario di rivedere rapidamente la curva di rischio in tempo reale e le previsioni di rischio storiche, incluso se l’IDH si è verificato durante l’ultima dialisi. (Gervasoni et al. 2023) nel loro studio studio hanno sviluppato due modelli di rischio che prevedessero il verificarsi di IDH sintomatica nel successivo trattamento di emodialisi (NextTreat-IDH), nonché quattro o più episodi di IDH sintomatica nel mese successivo (NextMonth-4IDH). L’algoritmo XGBoost per la previsione dell’occorrenza di IDH nella successiva sessione di dialisi e nel mese successivo ha avuto un’AUC di 0,84 e un PR di 0,48. Nonostante però la rilevanza del problema, le differenze nelle definizioni IDH e la mancanza di dati inequivocabili riguardanti le implicazioni delle varie manifestazioni cliniche associate alla bassa pressione sanguigna durante la dialisi, rendono questo evento difficile da gestire. (Hong D. et al. 2023) hanno costruito un sistema di allerta precoce utilizzando il modello RF (Random Forest) che ha dimostrato le migliori prestazioni (AUROC = 0,812) per la previsione dell’IDH prima di iniziare l’emodialisi. Incorporandolo nel software di dialisi e utilizzandolo come sottopagina, questo modello effettua la previsione in anticipo del rischio di IDH prevista prima della dialisi.
- PREDIRE IDH ATTRAVERSO SET DI DATI ESTRAPOLATI PRIMA E/O DURANTE IL TRATTAMENTO DIALITICO
(Gómez-Pulido et al. 2021) hanno utilizzato classificatori DT e SVM tramite 22 parametri clinici, riportando rispettivamente accuratezze del 74-81% e del 74-80% per prevedere l’ipotensione durante le sessioni di emodialisi con valori di specificità superiori al 90% in tutti i casi. (Barbieri et al. 2019) hanno sviluppato una rete neurale artificiale (ANN) multistrato combinandolo con 60 caratteristiche del paziente per raggiungere il compromesso ottimale che minimizzi il rischio associato alla gestione emodinamica (IDH) ed al contempo raggiunga l’adeguatezza del trattamento dialitico, migliorando l’esito cardiovascolare dei pazienti in emodialisi, ottenendo un’accuratezza di previsione accettabile. (Lee H. et al. 2023) hanno combinanto i dati clinici delle tre sessioni più recenti creando un modello di intelligenza artificiale basato sull’apprendimento profondo predittivo sulla rete neurale convoluzionale unidimensionale (1D-CNN) ottenendo le migliori prestazioni predittive, prevedendo con precisione l’IDH con valori AUROC e AUPRC rispettivamente di 0,87 e 0,35 costituendo uno strumento di screening affidabile e che consente al personale sanitario di identificare i pazienti vulnerabili e di adattare le impostazioni prima del trattamento emodialitico. Zhang M. et al. (2024) hanno utilizzato il metodo TreeSHAP per fornire spiegazioni globali e individuali per il modello di previsione del rischio di IDH, rendendo possibile prevedere gli eventi di IDH durante l’emodialisi rilevando una sola misurazione della pressione sanguigna prima dell’inizio del trattamento, consentendo al team medico di gestire e prevenire tempestivamente l’IDH con un’accuratezza di 0,92 e un’AUC di 0,95. (Yun D. et al. 2023) hanno preso in considerazione non solo gli episodi IDH nelle sessioni di HD ma anche gli episodi di ipertensione intra dialitica (IDHTN) introducendo un nuovo modello per la previsione simultanea in tempo reale di IDH e IDHTN incorporando le informazioni da sessioni precedenti di emodialisi, sviluppando un modello basato sul trasformatore di fusione temporale (TFT) raggiungendo AUROC pari a 0,953, 0,892 e 0,889 nel predire rispettivamente IDH-1, IDH-2 e IDHTN aiutando il personale ad intervenire in anticipo sia per IDH che per IDHTN. Il lavoro di (Othman et al. 2022) allo stesso modo, ha incluso oltre all’ ipotensione, anche altre complicanze intra dialitiche come ipertensione e dispnea, considerando le condizioni ambientali come la temperatura dell’ambiente e l’umidità, nonché il consumo di pasti durante la dialisi, fattori che vengono spesso trascurati e che si sono rivelati significativi. Lo studio, basato sull’ algoritmo Random Forest ha ottenuto la previsione del rischio di IDH in base alla pressione sanguigna rilevata prima dell’inizio dell’emodialisi e ad altre caratteristiche cliniche, consentendo così al team medico di adattare rapidamente le prescrizioni emodialitiche, per una gestione e una prevenzione tempestiva di IDH, con un’accuratezza del 98%. Nello studio retrospettivo (Huang J. C. et al. 2020) hanno sviluppato un sistema intelligente con capacità di prevedere la pressione sanguigna (BP) durante l’HD e confrontare ulteriormente diversi algoritmi di apprendimento automatico per la previsione della pressione sistolica successiva (SBP). Il metodo RF è il più accurato ed il metodo di ensemble presenta le migliori prestazioni predittive, supportando il personale di dialisi nell’assistenza personalizzata e nell’intervento tempestivo, migliorando così l’assistenza ai pazienti di dialisi e la loro sicurezza.
DISCUSSIONE
I risultati degli studi inclusi nella presente revisione evidenziano il potenziale di questi moderni approcci computazionali per affrontare la sfida di lunga data dell’IDH, dacchè è stata associata a esiti clinici avversi e ad un maggiore utilizzo dell’assistenza sanitaria. (Sands JJ et al., 2014 – Stefánsson BV. et al., 2014) . Negli studi esaminati è stata impiegata una vasta gamma di algoritmi AI/ML, tra cui ANN, DT, SVM, XGBoost, RF e LightGBM, metodi di ensamble.
Questa diversità sottolinea la versatilità e l’adattabilità delle tecniche AI/ML nell’affrontare compiti predittivi complessi poiché, ogni algoritmo, opera su principi diversi e può essere più adatto a strutture di dati o domini problematici specifici. Incorporando diversi set di funzionalità, questi modelli possono rilevare l’intricata interazione di vari fattori di rischio e potenzialmente fornire previsioni più accurate e personalizzate. Tuttavia, è essenziale riconoscere i limiti degli studi esaminati. La maggior parte degli studi ha utilizzato progetti retrospettivi che possono introdurre bias e limitare la generalizzabilità dei risultati. Un’altra considerazione critica è l’integrazione di questi modelli predittivi nei sistemi di supporto alle decisioni cliniche (CDSS). Incorporando, senza soluzione di continuità, i modelli AI/ML nei sistemi delle cartelle cliniche elettroniche e nei flussi di lavoro clinici esistenti, gli operatori sanitari possono sfruttare queste capacità analitiche avanzate per guidare strategie di trattamento personalizzate e misure preventive per l’IDH. Purtroppo, l’implementazione di successo di tali CDSS richiede un’attenta esperienza dell’utente, della privacy dei dati e della conformità normativa. Nondimeno, l’interpretabilità e la trasparenza dei modelli AI/ML restano un problema, giacché molti algoritmi operano come “scatole nere”, rendendo difficile comprendere i processi decisionali sottostanti.
CONCLUSIONI
Nonostante i numerosi progressi nella gestione della dialisi, l’IDH rimane un problema pervasivo. A causa principalmente della mancanza di una definizione generalmente accettata, la sua vera prevalenza rimane poco chiara. La sintomatologia clinica dell’IDH si sovrappone ampiamente alla deplezione effettiva del volume intravascolare; è associata a notevole sofferenza del paziente, ad episodi ricorrenti di ischemia transitoria degli organi e ad un rischio aumentato di morbilità e mortalità cardiovascolare immediata e futura. L’uso di tecnologie innovative potrebbe aiutare a rilevare e prevedere l’IDH, consentendo interventi precoci e migliori risultati per i pazienti.
I risultati di questa revisione evidenziano il potenziale di sfruttare l’applicazione di modelli di apprendimento automatico per la previsione dell’IDH aprendo le porte a interventi preventivi per prevenire questa complicanza nei pazienti sottoposti a dialisi.
La ricerca futura dovrebbe concentrarsi su studi su larga scala con raccolta di dati standardizzata e convalida di modelli di apprendimento automatico in diverse popolazioni di pazienti per far progredire ulteriormente il campo. Inoltre, l’integrazione di dati fisiologici in tempo reale da dispositivi di monitoraggio in modelli di apprendimento automatico può migliorare la loro accuratezza e utilità clinica. In conclusione, questi modelli possono potenzialmente migliorare la stratificazione del rischio e guidare interventi proattivi per mitigare l’insorgenza di IDH durante i trattamenti di dialisi, sfruttandoli come un alleato, come un sistema di supporto alle decisioni e non come un sostituto del giudizio clinico, riducendo la vigilanza dei professionisti.
POSTER
BIBLIOGRAFIA
- Kalantar-Zadeh K, Jafar TH, Nitsch D, Neuen BL, Perkovic V. Chronic kidney disease. Lancet. 2021;398(10302):786–802. doi:10.1016/S0140- 6736(21)00519-5
- Saran R, Robinson B, Abbott KC et al. US Renal DataSystem 2018 annual data report: epidemiology of kidney disease in the United States. Am J Kidney Dis 2019; 73: A7–A8
- Yu J, Liu Z, Shen B et al. Intradialytic hypotension as an independent risk factor for long-term mortality in maintaining hemodialysis patients: a 5-year follow-up cohort study. Blood Purif 2018; 45: 320–326–5
- Kuipers J, Verboom LM, Ipema KJR et al. The prevalence of intradialytic hypotension in patients on conventional hemodialysis: a systematic review with meta-analysis. Am J Nephrol 2019; 49: 497–506
- K/DOQI Workgroup. K/DOQI clinical practice guidelines for cardiovascular disease in dialysis patients. Am J Kidney Dis. 2005;45(4 suppl 3):S1–S153
- Kooman J, Basci A, Pizzarelli F, et al. EBPG guideline on haemodynamic instability. Nephrol Dial Transplant. 2007;22(suppl 2):ii22–ii44
- Flythe JE, Xue H, Lynch KE, Curhan GC, Brunelli SM. Association of mortality risk with various definitions of intradialytic hypotension. J Am Soc Nephrol. 2015;26:724-34. doi:10.1681/ASN.2014020222
- Ashby D, Borman N, Burton J, et al. Renal Association clinical practice guideline on haemodialysis. BMC Nephrol. 2019;20:379. https://doi.org/10.1186/s12882-019-1527-3
- Assimon MM, Flythe JE. Definitions of intradialytic hypotension. Semin Dial. 2017;30:464–472. https://doi.org/10. 1111/sdi.12626
- Burton JO, Jefferies HJ, Selby NM, McIntyre CW. Hemodialysis-induced repetitive myocardial injury results in global and segmental reduction in systolic cardiac function. Clin J Am Soc Nephrol. 2009;4:1925-31. doi:10.2215/CJN.04470709
- Mizumasa T, Hirakata H, Yoshimitsu T, Hirakata E, Kubo M, Kashiwagi M, et al. Dialysis-related hypotension as a cause of progressivenfrontal lobe atrophy in chronic hemodialysis patients: A 3-year prospective study. Nephron – Clin Pract. 2004;97:c23-30.doi:10.1159/000077592
- McIntyre CW, Goldsmith DJ. Ischemic brain injury in hemodialysis patients: which is more dangerous, hypertension or intradialytic hypotension?. Kidney Int. 2015;87:1109-15. doi:10.1038/ki.2015.62
- Daugirdas JT: Pathophysiology of dialysis hypotension: an update . Am J Kidney Dis. 2001, 38:S11-7. 10.1053/ajkd.2001.28090
- Hajal J, Joubran N, Sleilaty G, Chacra D, Saliba Y, Assaad S, et al. Intradialytic hypotension: beyond hemodynamics. Physiol Res. 2019;68:793-805. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/31424249
- Stefánsson BV, Brunelli SM, Cabrera C, et al.: Intradialytic hypotension and risk of cardiovascular disease . Clin J Am Soc Nephrol. 2014, 9:2124-32. 10.2215/CJN.02680314
- Sulowicz W, Radziszewski A: Pathogenesis and treatment of dialysis hypotension . Kidney Int. 2006, 70:S36- 9. 10.1038/sj.ki.5001975
- Sars B, Van Der Sande FM, Kooman JP. Intradialytic hypotension: Mechanisms and outcome. Blood Purif. 2020;49:158-67. doi:10.1159/000503776
- Kanbay M, Ertuglu LA, Afsar B, Ozdogan E, Siriopol D, Covic A, Basile C, Ortiz A. An update review of intradialytic hypotension: concept, risk factors, clinical implications and management. Clin Kidney J. 2020 Jul 8;13(6):981-993. doi: 10.1093/ckj/sfaa078. PMID: 33391741; PMCID: PMC7769545
- Juan Manuel Buades Fuster, María Rosario Bernabéu Lafuente, María Asunción Ferrer Nadal, Susana García Melendreras, María Victoria Iñigo Vanrell, Marilisa Molina Guasch REVISIÓN MONOGRÁFICA Avances en diálisis. Monitorización de datos con tecnologías emergentes.Servicio de Nefrología. Hospital Universitario Son Llàtzer. Palma de Mallorca NefroPlus 2021;13(2):1-11 © 2021 Sociedad Española de Nefrología. Servicios de edición de Elsevier España S.L.U.
- Chou, J.A., K. Kalantar‐Zadeh, and A.T. Mathew. A brief review of intradialytic hypotension with a focus on survival. in Seminars in dialysis. 2017. Wiley Online Library
- Hamrahian, S.M., et al., Prevention of Intradialytic Hypotension in Hemodialysis Patients: Current Challenges and Future Prospects. International Journal of Nephrology and Renovascular Disease, 2023: p. 173-181
- Cedeno, S., et al., Intradialytic hypotension definitions with mortality prediction capacity in a cohort of haemodialysis patients. Nefrología (English Edition), 2020. 40(4): p. 402-412.
- What Is Artificial Intelligence? Definition, Uses, and Types. 2020 [cited 2024 2024-5-11]; Available from: https://www.coursera.org/articles/what-is-artificial-intelligence
- Suckling RJ, Swift PA, He FJ, Markandu ND, MacGregor GA: Altering plasma sodium concentration rapidly changes blood pressure during haemodialysis. Nephrol Dial Transplant. 2013, 28:2181-6. 10.1093/ndt/gft081
- Gaweda AE, Lederer ED, Brier ME: Artificial intelligence-guided precision treatment of chronic kidney disease-mineral bone disorder. CPT Pharmacometrics Syst Pharmacol. 2022, 11:1305-15. 10.1002/psp4.12843
- Tomasev N, Glorot X, Rae JW, et al. A clinically applicable approach to continuous prediction of future acute kidney injury. Nature. 2019;572(7767):116-119
- Makino M, Yoshimoto R, Ono M, et al. Artificial intelligence predicts the progression of diabetic kidney disease using big data machine learning. Sci Rep. 2019;9(1):11862
- Niel O, Bastard P. Artificial intelligence improves estimation of tacrolimus area under the concentration over time curve in renal transplant recipients. Transpl Int. 2018;31(8):940-941
- Lin SY, Hsieh MH, Lin CL, et al. Artificial intelligence prediction model for the cost and mortality of renal replacement therapy in aged and super-aged populations in Taiwan. J Clin Med. 2019;8(7):995
- Becker JU, Mayerich D, Padmanabhan M, et al. Artificial intelligence and machine learning in nephropathology. Kidney Int. 2020;98(1):65-75
- Ligabue G, Pollastri F, Fontana F, et al. Evaluation of the classification accuracy of the kidney biopsy direct immunofluorescence through convolutional neural networks. Clin J Am Soc Nephrol. 2020;15(10):1445-1454
- Intelligenza Artificiale: un valido alleato nel percorso diagnostico-terapeutico del paziente cardiopatico https://siia.it/aggiornamento-formazione/news/intelligenza-artificiale-un-valido-alleato-nel-percorso-diagnostico-terapeutico-del-paziente-cardiopatico/ consultato in data 19/01/2025
- Precision Dialysis: Leveraging Big Data and Artificial Intelligence Ehsan Nobakht, Wubit Raru, Sherry Dadgar, and Osama El Sham Kidney Med. 6(9):100868. Published online July 14, 2024. doi: 10.1016/ j.xkme.2024.100868
- Sands JJ, Usvyat LA, Sullivan T, et al.: Intradialytic hypotension: frequency, sources of variation and correlation with clinical outcome. Hemodial Int. 2014, 18:415-22. 10.1111/hdi.12138
- Stefánsson BV, Brunelli SM, Cabrera C, et al.: Intradialytic hypotension and risk of cardiovascular disease . Clin J Am Soc Nephrol. 2014, 9:2124-32. 10.2215/CJN.02680314
- Gómez-Pulido JA, Gómez-Pulido JM, Rodríguez-Puyol D, Polo-Luque ML, Vargas-Lombardo M: Predicting the appearance of hypotension during hemodialysis sessions using machine learning classifiers. Int J Environ Res Public Health. 2021, 18:2364. 10.3390/ijerph18052364
- Barbieri C, Cattinelli I, Neri L, et al.: Development of an artificial intelligence model to guide the management of blood pressure, fluid volume, and dialysis dose in end-stage kidney disease patients: proof of concept and first clinical assessment. Kidney Dis (Basel). 2019, 5:28-33. 10.1159/000493479
- Molnar C: Interpretable Machine Learning: A Guide for Making Black Box Models Explainable . 2024
- Lee H, Moon SJ, Kim SW, Min JW, Park HS, Yoon HE, Kim YS, Kim HW, Yang CW, Chung S, Koh ES, Chung BH. Prediction of intradialytic hypotension using pre-dialysis features-a deep learning-based artificial intelligence model. Nephrol Dial Transplant. 2023 Sep 29;38(10):2310-2320. doi: 10.1093/ndt/gfad064. PMID: 37019834.
- Lee H, Yun D, Yoo J, Yoo K, Kim YC, Kim DK, Oh KH, Joo KW, Kim YS, Kwak N, Han SS. Deep Learning Model for Real-Time Prediction of Intradialytic Hypotension. Clin J Am Soc Nephrol. 2021 Mar 8;16(3):396-406. doi: 10.2215/CJN.09280620. Epub 2021 Feb 11. PMID: 33574056; PMCID: PMC8011016
- Sandys V, Sexton D, O’Seaghdha C: Artificial intelligence and digital health for volume maintenance in hemodialysis patients. Hemodial Int. 2022, 26:480-95. 10.1111/hdi.13033
- World Health Organization. WHO outlines considerations for regulation of artificial intelligence for health. Accessed Decenber 2024. https://www.who.int/news/item/19-10-2023-who-outlines- considerations-for-regulation-of-artificial-intelligence-forhealth
- Baethge C, Goldbeck-Wood S, Mertens S. SANRA-a scale for the quality assessment of narrative review articles. Res Integr Peer Rev. 2019 Mar 26;4:5. doi: 10.1186/s41073-019-0064-8. PMID: 30962953; PMCID: PMC6434870.
- Grant MJ, Booth A. A typology of reviews: an analysis of 14 review types and associated methodologies. Health Info Libr J. 2009 Jun;26(2):91-108. doi: 10.1111/j.1471-1842.2009.00848.x. PMID: 19490148.
- Yun D, Yang HL, Kim SG, Kim K, Kim DK, Oh KH, Joo KW, Kim YS, Han SS. Real-time dual prediction of intradialytic hypotension and hypertension using an explainable deep learning model. Sci Rep. 2023 Oct 23;13(1):18054. doi: 10.1038/s41598-023-45282-1. PMID: 37872390; PMCID: PMC10593747
- Chou JA, Streja E, Nguyen DV, Rhee CM, Obi Y, Inrig JK, Amin A, Kovesdy CP, Sim JJ, Kalantar-Zadeh K. Intradialytic hypotension, blood pressure changes and mortality risk in incident hemodialysis patients. Nephrol Dial Transplant. 2018 Jan 1;33(1):149-159. doi: 10.1093/ndt/gfx037. PMID: 28444336; PMCID: PMC5837776.
- Levey AS, Eckardt KU, Tsukamoto Y, Levin A, Coresh J, Rossert J, De Zeeuw D, Hostetter TH, Lameire N, Eknoyan G. Definition and classification of chronic kidney disease: a position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int. 2005 Jun;67(6):2089-100. doi: 10.1111/j.1523-1755.2005.00365.x. PMID: 15882252.
- Stevens PE, Levin A; Kidney Disease: Improving Global Outcomes Chronic Kidney Disease Guideline Development Work Group Members. Evaluation and management of chronic kidney disease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline. Ann Intern Med. 2013 Jun 4;158(11):825-30. doi: 10.7326/0003-4819-158-11-201306040-00007. PMID: 23732715.
- Barbieri C. et al/Spagna/2019/ Development of an artificial intelligence model to guide the management of blood pressure, fluid volume, and dialysis dose in end-stage kidney disease patients: Proof of concept and first clinical assessment.
- Nafisi V.R et al./Iran/2018/Intradialytic hypotension related episodes identification based on the most effective features of photoplethysmography signal.
- Jin-Bor Chen et al/Taiwan/2020/ Deep Learning for Intradialytic Hypotension Prediction in Hemodialysis Patients.
- Mendoza – Pittì et al./Spagna/2022/ Machine-Learning Model to Predict the Intradialytic Hypotension Based on Clinical-Analytical Data.
- Zhang, M. et al/2024/Taiwan/Construction and Explanation Analysis of a Hypotension Risk Prediction Model in Hemodialysis Based on Machine Learning.
- Othman et al/2022/Egitto/Early prediction of hemodialysis complications employing ensemble techniques.
- -C. Huang et al./Taiwan/2020/ Predictive modeling of blood pressure during hemodialysis: a comparison of linear model, random forest, support vector regression, XGBoost, LASSO regression and ensemble method.
- Yupeng Li et al/2022/Cina/ Intradialytic hypotension prediction using covariance matrix-driven whale optimizer with orthogonal structure-assisted extreme learning machine.
- Lee H. et al/2021/Corea/ Deep Learning Model for Real-Time Prediction of Intradialytic Hypotension.
- Yang IN et al/2024/Taiwan/Personalized prediction of intradialytic hypotension in clinical practice: Development and evaluation of a novel AI dashboard incorporating risk factors from previous and current dialysis sessions.
- Hong D. et al./2023/Cina/ Construction of an Early Alert System for Intradialytic Hypotension before Initiating Hemodialysis Based on Machine Learning.
- Gervasoni et al./2023/Portogallo/Spagna/Development and validation of AI-based triage support algorithms for prevention of intradialytic hypotension.
- Yun D. et al/2023/Corea/Real-time dual prediction of intradialytic hypotension and hypertension using an explainable deep learning model.
- Gomez-Pulido et al/2021/Spagna/ Predicting the Appearance of Hypotension During Hemodialysis Sessions Using Machine Learning Classifiers.
- Zhang H. et.al/2023/Stati Uniti/ Real-time prediction of intradialytic hypotension using machine learning and cloud computing infrastructure.
- Dong/2023/Cina/ Machine learning-based intradialytic hypotension prediction of patients undergoing hemodialysis: A multicenter retrospective study.
- Lee H. et al/2023/Corea/Prediction of intradialytic hypotension using pre-dialysis features-a deep learning-based artificial intelligence model.